Bài viết dưới đây sẽ cho các em biết phương pháp để điều chế, sản xuất Oxi trong phòng thí nghiệm và trong công nghiệp, đồng thời các em biết thêm 1 loại phản ứng mới, đó là phản ứng phân huỷ.
I. Điều chế và sản xuất Oxi (O2) trong phòng thí nghiệm
– Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách đun nóng những hợp chất giàu oxi và dễ phân hủy ở nhiệt độ cao như KMnO4 và KClO3.
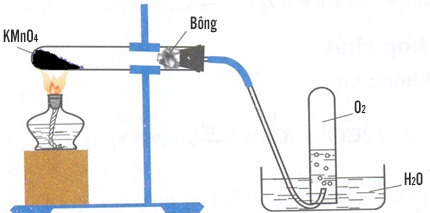
Điều chế Oxi trong phòng thí nghiệm
– Điều chế Oxi từ nguyên liệu là kali pemanganat KMnO4
2KMnO4 K2MnO4 + MnO2 + O2.
– Điều chế Oxi bằng từ nguyên liệu là kali clorat KClO3
2KClO3 2KCl + 3O2.
* Cách 2 cách thu khí Oxi:
+ Bằng cách đẩy không khí.
+ Bằng cách đẩy nước.
II. Điều chế và sản xuất Oxi (O2) trong công nghiệp
* Trong công nghiệp để điều chế và sản xuất Oxi người ta sử dụng nguyên liệu là Không khí và nước.
điều chế oxi trong công nghiệp
1. Sản xuất khí oxi từ không khí.
– Người ta hoá lỏng không khí ở nhiệt độ thấp và áp suất cao, sau đó cho không khí lòng bay hơi, đầu tiên thu được khí Nito (-1960C) sau đó là khí Oxi (-1830C).
2. Sản xuất khí oxi từ nước.
– Điện phân nước trong các bình điện phân, thu được 2 chất khí riêng biệt là Oxi và Hidro
2H2O 2H2 + O2
– Khí Oxi dùng trong công nghiệp thường được hoá lỏng và được nén dưới áp suất cao trong các bình thép.
III. Phản ứng phân huỷ
– Phản ứng phân huỷ là gì: Phản ứng phân huỷ là phản ứng hoá học trong đó một chất sinh ra hai hay nhiều chất mới;
* Ví dụ:
2KMnO4 K2MnO4 + MnO2 + O2.
2KClO3 2KCl + 3O2.
2H2O 2H2 + O2
2Fe(OH)3 Fe2O3 + 3H2O
IV. Bài tập vận dụng điều chế và sản xuất Oxi
* Bài 1 trang 94 SGK hoá 8: Những chất nào trong số những chất sau được dùng để điều chế oxi trong phòng thí nghiệm:
a) Fe3O4 ; b) KClO3 ; c) KMnO4;
d) CaCO3 ; e) Không khí ; g) H2O.
>> Giải bài 1 trang 94 SGK hoá 8
* Bài 2 trang 94 SGK hoá 8: Sự khác nhau về cách điều chế oxi trong phòng thí nghiệm và trong công nghiệp về nguyên liệu, sản lượng và giá thành?
>> Giải bài 2 trang 94 SGK hoá 8
* Bài 3 trang 94 SGK hoá 8: Sự khác nhau giữa phản ứng phân hủy và phản ứng hóa hợp? Dẫn ra 2 thí dụ để minh họa.
>> Giải bài 3 trang 94 SGK hoá 8
* Bài 4 trang 94 SGK hoá 8: Tính số mol và số gam kali clorat cần thiết để điều chế được:
a) 48g khí oxi.
b) 44,8 lít khí oxi (ở đktc).
>> Giải bài 4 trang 94 SGK hoá 8
* Bài 5 trang 94 SGK hoá 8: Nung đá vôi CaCO3 được vôi sống CaO và khí cacbonic CO2.
a) Viết phương trình hóa học của phản ứng.
b) Phản ứng nung vôi thuộc loại phản ứng hóa học nào? Vì sao?
>> Giải bài 5 trang 94 SGK hoá 8
* Bài 6 trang 94 SGK hoá 8: Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng oxi hóa sắt ở nhiệt độ cao.
a) Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxi sắt từ?
b) Tính số gam kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol KMnO4 thì thu được 1 mol O2.
>> Giải bài 6 trang 94 SGK hoá 8
